(Reseña publicada en la WEB de la SEPEAP el 6 de Febrero de 2009)
Durante las últimas 2 décadas la prevalencia de obesidad, entendida como un índice de masa corporal por encima del percentil 95 para la edad, se ha triplicado, pasando del 6.5% al 18.8% en niños de 5 a 11 años; en adolescentes se ha pasado del 5% al 17.4%. Las consecuencias de la obesidad infanto-juvenil sobre morbilidad y mortalidad de la población se harán notar en las décadas siguientes. La obesidad de los niños y adolescentes se acompaña de múltiples complicaciones a medio y largo plazo, considerándose como factor etiológico de gran cantidad de enfermedades crónicas: diabetes mellitus tipo 2, enfermedades cardiovasculares, hipertensión arterial, ateroesclerosis, cáncer (cólon, endometrio y mama), enfermedades cerebrovasculares, litiasis biliar, osteoartritis, gota y apnea del sueño.
El incremento de la prevalencia de la obesidad ha alcanzado proporciones epidémicas durante la última década; en algunas Comunidades Autónomas del estado Español se alcanzan proporciones próximas al 30% de la población infantil. Este incremento de nuevos casos de obesidad ha ocurrido de forma paralela al incremento de otras patologías crónicas como puede ser el asma infantil. Aunque algunos autores han querido ver en la obesidad mas una con secuencia del asma crónico mal controlado que una causa, lo cierto es que existen elementos para pensar en la obesidad como factor etiopatogénico del primer orden en el desarrollo de asma.
En L. A. Barness. Obesity in children. Fetal Pediatr Pathol. 26 (2):75-85, 2007; se publicó una revisión del estado de conocimiento actual en obesidad infantil.
La obesidad se puede definir como un aumento de la grasa corporal por encima de los valores considerados de referencia. Sin embrago, caben otras definiciones según qué parámetro consideremos:
- Desde el punto de vista antropométrico: peso observado x 100 / peso esperado para la talla; si este cociente es mayor de 110% hablamos de sobrepeso, si es mayor de 120% hablamos de obesidad.
- Espesor de los pliegues cutáneos por encima del percentil 95.
- Índice de masa corporal: Normal en adultos de 19 a 28.
- Composición corporal: en sujetos normales el porcentaje de grasa corporal total es del 12 al 30% del peso.

El aumento de la prevalencia de obesidad tanto en el niño como en el adulto puede ser justificada en parte por cambios en el entorno, en concreto la existencia de una oferta en los países industrializados de una oferta casi ilimitada de alimentos, que además tienen un alto poder calórico y un sabor agradable; esto unido a un estilo de vida sedentario, caracterizado por un consumo excesivo de energía y una reducción notable en la actividad física. La obesidad representa el arquetipo de una enfermedad de tipo multifactorial donde se imbrican factores ambientales, genéticos y de adaptación al medio. Partiendo de los datos del estudio de Youth de 1979, en Li Yan Wang, David Chyen, Sarah Lee, and Richard Lowry. The Association Between Body Mass Index in Adolescence and Obesity in Adulthood. Journal of Adolescent Health 42 (5):512-518, 2008; se estudia la asociación entre obesidad en adoescentes y obesidad en adultos. Según esta cohorte a la edad de 16/17 años el 11% de la muestra tiene un índice masa corporal superior al percentil 85% (sobrepeso) y el 3% tiene un índice de masa corporal superior al percentil 95 (obesos). A la edad de 37/38 años el 69% de la muestra tienen sobrepeso y el 26% son obesos. Según este estudio el riesgo de que un adolescente obeso sea obeso al llegar a los 37 años es 18 veces mayor en los varones y 49 veces mayor en las mujeres. La figura adjunta representa las predicciones de obesidad en el adulto para los índices de masa corporal a las edad de 16-17 años.
El aumento del tejido adiposo supone un aumento de la producción de citokinas y un aumento de sustrato para la peroxidación lipídica, la relación entre estrés oxidativo y asma es un campo de investigación que ha dado en los últimos años importantes descubrimientos. La comorbilidad observada entre obesidad y patología cardiovascular, problemas ortopédicos, diabetes mellitus tipo 2 por citar algunos ejemplos deben hacernos plantearnos la urgencia de adoptar medidas profilácticas y terapéuticas eficaces para abordar el problema de la obesidad infantil.
A diferencia de lo que ocurre en etapas posteriores de la vida el tratamiento de la obesidad puede beneficiarse del crecimiento y de los aumentos de masa corporal; por tanto en vez de reducir el tamaño de las células adiposas, el tratamiento de la obesidad a una edad temprana evita el desarrollo de excesivas células adiposas. Por tanto, en niños y adolescentes el enfoque óptimo del tratamiento de la obesidad no es tanto perder peso como conseguir estabilizar el índice de masa corporal (IMC). Sin embargo, durante la infancia el IMC es un mal indicador del exceso de grasa, por lo que algunos autores han propuesto como objetivos terapéuticos en la obesidad conseguir mejorar el perfil de los factores de riesgo cardiovascular en la infancia. Otros estudios han utilizado la impedanciometria bioeléctrica en un intento de evaluar de forma mas exacta las concentraciones de grasa del organismo en niños obesos.
Este aspecto es el desarrollado por L. A. Moreno. Interventions to improve cardiovascular risk factors in obese children. J Pediatr Gastroenterol.Nutr. 43 (4):433-435, 2006. Tras analizar las diferentes evidencias disponibles en la actualidad se observa que los tratamiento en régimen ambulatorio son mas efectivos sobre los factores de riesgo cardiovascular que los tratamientos en régimen de internado. La mayoría de los ensayos que evalúan intervenciones en el régimen escolar o familiar consistentes en regímenes de ejercicio encaminados a estilos de vida y dieta, observan mejoría en los factores de riesgo cardiovascular.
Estudios recientes han observado que la mejora de los factores de riesgo cardiovascular es paralela a los cambios positivos en la función endotelial y el grosor de la íntima vascular. En su editorial L.A. Moreno concluye que dada la elevada prevalencia de obesidad en los países desarrollados que parece ir en aumento, deben desarrollarse estrategias no sólo de tratamiento, sino también de prevención de la obesidad.
De entre las guías de práctica clínica para la prevención y tratamiento de la obesidad infantil he seleccionado dos:
- Scotish Intercollegiate Guideline Network. Management of obesity in children and young people. A national guideline. Scotish Intercollegiate Guideline Network. En: http://www.sign.ac.uk/pdf/sign69.pdf , 2003.
- National Health & Medical Research Council of Australia. Clinical practice guidelines for the management of overweight and obesity in children and adolescents. http://www.health.gov.au/internet/wcms/publishing.nsf/Content/obesityguidelines-guidelines-children.htm , 2003.
Sin duda, uno de los aspectos mas importantes de esta guía es que se consensuan la medida del índice de masa corporal (IMC) para el diagnóstico de la obesidad infantil, así como los puntos de corte. El índice de masa corporal, sobre todo por encima del percentil 90, tiene alta especificidad y moderada-baja sensibilidad, de esta forma se convierte en una herramienta útil para descartar niños sin obesidad infantil. Los puntos de corte considerados son entre p85-p95 para sobrepeso y por encima del pecentil 95 para obesidad.
Ambas guías han servido de base para la confección de documentos de trabajo como el recientemente publicado por la Junta de Andalucía, Plan integral de obesidad infantil, que aborda el problema de la obesidad desde varios campos de actuación, pretendiendo una concienciación de la Sociedad e intentando promover estilos de vida saludables en la población.
Aunque el papel de los genes en la regulación de la adiposidad, es un hecho aceptado que los recientes cambios en la prevalencia de la obesidad no se deben a cambios en la genética de los humanos; si bien existen una serie de alteraciones bien conocidas de base genética que conviene remarcar y que Sadaf I. Farooqi. Genetic and hereditary aspects of childhood obesity. Best Practice & Research Clinical Endocrinology & Metabolism 19 (3):359-374, 2005; revisan en su artículo.
En los niños obesos se han descrito los siguientes hallazgos endocrinológicos:
- Disminuye la GH basal y secundaria a estímulos hipotalámicos e hipofisarios. Las somatomedinas circulantes son normales.
- Aumenta la prolactina basal, pero disminuye la secreción en respuesta a estímulos.
- LH y FSH normales.
- T4 normal. T3 normal o aumentado. TSH normal o disminuida. T3r normal.
- Cortisol normal. Aumento de la producción y excreción de metabolitos de cortisol. Cortisol libre en orina normal. Aumento en suero de los andrógenos adrenales y dehidroepiandrosterona.
- A nivel testicular: Testosterona total en suero disminuida con fracción libre normal por disminución de la globulina transportadora. Aumento de los estrógenos, pero raramente con síntomas de hiperestrogenismo.
- A nivel ovárico: Estrógenos en suero normales. Disminuye la globulina transportadora. Aumenta la incidencia de dismenorrea, sangrado uterino disfuncional y síndrome de ovario poliquístico.
- Aumenta la insulina y liberación de glucagón. Aumenta la resistencia a la insulina.
I. Alteraciones monogénicas.
La homeostasis de la energía en el ser humano implica la interacción de diversas señales aferentes de asa larga para las grasas (leptinas) y células pancreáticas (insulina) y de asa corta relacionadas con señales aferentes de regulación del gusto, inhibidores del apetito (glucagón, péptido Y, colecistokinina) y estimulantes del apetito (Ghrelina). Todos estos impulsos se integran en el cerebro que regula la ingestión de alimentos. La hormona producida por los adipocitos (leptina) circua en sangre de forma proporcional al contenido graso del organismo, puede cruzar la barrera hematoencefálica e interactúa con receptores hipotalámicos del núcleo arcuato para regular el apetito y el balance de energía. Otra vía de regulación que utiliza el cerebro para regular el apetito y la ingesta de energía es la síntesis de proopiomelanocortina.
La deficiencia congénita de leptina se ha implicado en algunas causas genéticas de obesidad y se ha podido demostrar que la administración diaria subcutánea de leptina puede normalizar la hiperfagia y corregir la obesidad. Sin embargo, tras 6 semanas de tratamiento con leptinas se observa producción anticuerpos frente a leptina que limitan la utilidad de esta terapia.
Otra mutación identificada relacionada con algunos síndromes de obesidad de causa genética es la deficiencia de receptor de leptina, clínicamente tiene unas manifestaciones similares a la deficiencia de leptina con niveles de cortisol normales en sangre.
La deficiencia de proopiomelanocortina se identifica durante el periodo neonatal por la presentación de una crisis adisoniana por defecto de ACTH, y palidez de piel, ya que la proopiomelanocortina es el precursor de la ACTH y MSH (hormona melanocito estimulante) en la hipófisis. El defecto de proopiomelanocortina origina disminución de la señal de la MSH implicada también en la regulación del apetito, en consecuencia se origina hiperfagia. De igual forma se ha identificado obesidad en sujetos en los que ha podido demostrarse deficiencia del receptor de la melanocortina-4, esta deficiencia es la generalmente implicada en la obesidad observada en el síndrome de Prader-Willi y síndrome X frágil.
II. Síndrome pleiotrópicos.
Existen una serie de anomalías de base genética donde además de la obesidad existen una serie de alteraciones del desarrollo específico en determinados organos; en estos síndrome se pueden incluir:
- Síndrome de Bardet-Biedl. De herencia autosómica recesiva con una prevalencia inferior a 1/100.000. Se caracteriza por obesidad central, retraso mental, retinopatía retiniana, deformidad de extremidades, anomalías renales, hipogonadismo e hipogenitalismo.
- Osteodistrofia hereditaria de Albright. Es un trastorno autosómico dominante debido a una alteración en la línea germinal que dodifica la subunidad alfa de la proteína G. Fenotípicamente se caracteriza por la presencia de obesidad, baja estatura, cara redonda, braquidactilia, osificación de tejidos blandos y resistencia a dibersas hormonas que utilizan la proteína G en sus respuestas celulares (Pseudohipoparatiroidismo tipo IA).
- Síndrome X frágil. Este síndrome se caracteriza por la presencia de hallazgos como macrogenitalismo, pabellones auriculares grandes, retraso mental y prognatismo mandibular. Se debe a la expansión inestable del triplete CGG en locus específicos del cromosoma X.
- Síndrome de Borjeson–Forssman–Lehmann. Este síndrome se caracteriza por la presencia de retraso mental severo, epilepsia, hipogonadismo, ginecomastia y obesidad.
- Síndrome de Cohen. Es un trastorno autosómico recesivo caracterizado por la presencia de retraso mental, microcefalia, distrofia retinocoroidea y obesidad.
- Síndrome de Alstron. Trastorno autosómico recesivo que se caracteriza por la presencia de obesidad, hiperinsulinemia con hiperglucemia y defectos sensoriales. Son hallazgos asociados la presencia de cardiomiopatía dilatada, disfunción hepática, hipotiroidismo, hipogonadismo masculino, baja talla y retraso mental.

III. Síndromes por reestructuración cromosómica.
Síndrome de Prader-Willi. Responsable de la obesidad de causa síndromica mas frecuente, con una frecuencia estimada de 1/25000 nacidos vivos. Se caracteriza por la presencia de talla baja, obesidad, rasgos faciales característicos con frente amplia, retraso mental e hipogonadismo hipogonadotropo. El síndrome se debe a la ausencia del fragmento de cromosoma paterno 15q11.1-12q, lo que también se conoce como disomia uniparental materna, al existri unicamente expresión del fragmento de cromosoma procedente de la madre.
Síndrome WAGR. Se debe a delección 11p13. Cursa con la presencia de tumor de Wilms, anorexia, genitales ambiguos y retraso mental.
Prof. Jose Uberos Fernández
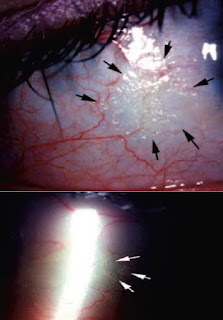 Su eficiencia origina ceguera en el niño y favorece el desarrollo de procesos infecciosos. Entre las causas que pueden originar deficiencia de vitamina A se citan los procesos diarreicos crónicos y malabsortivos (enfermedad celiaca, fibrosis quística) enfermedad hepática o dietas con bajo contenido en proteínas y grasas.
Su eficiencia origina ceguera en el niño y favorece el desarrollo de procesos infecciosos. Entre las causas que pueden originar deficiencia de vitamina A se citan los procesos diarreicos crónicos y malabsortivos (enfermedad celiaca, fibrosis quística) enfermedad hepática o dietas con bajo contenido en proteínas y grasas.